eCRF
Clinical Trial Software
-
 Badania kliniczne
Badania kliniczne
-
 Rejestry medyczne
Rejestry medyczne
-
 Badania naukowe
Badania naukowe
-
 Badania obserwacyjne
Badania obserwacyjne
Pomagamy w przygotowaniu przemyślanych i "inteligentnych" eCRF-ów (elektronicznych kart obserwacji pacjentów).
Oferujemy Państwu unikatowy na polskim rynku wielomodułowy system eCRF.biz.plTM, który powstał z myślą o naukowych potrzebach sektora farmaceutycznego. Projektując go kierowaliśmy się wytycznymi FDA (ang. Food and Drug Administration) czego efektem jest zgodność z Title 21 CFR Part 11.
System eCRF.bizTM (ang. clinical data management system) pozwoli Państwu na łatwe i bezpieczne gromadzenie danych, a przyjazny interfejs zostanie doceniony przez niejednego badacza. eCRF.biz.TM to zintegrowana platforma badawcza całkowicie eliminująca papierowe kwestionariusze obserwacji klinicznej i pozwalająca nam na kompleksowe zarządzanie całym projektem badawczym. Elektroniczny CRF (ang. electronic case report form) umożliwia dużo szybsze pozyskiwanie wyników, a co za tym idzie natychmiastową analizę danych na każdym etapie trwania badania.
Z naszego systemu eCRF.biz.TM korzysta szerokie grono specjalistów i ośrodków naukowych, których uwagi i sugestie są cennymi wskazówkami w procesie rozwoju i ciągłego udoskonalania systemu. W porozumieniu z Państwem możemy zaprojektować i zaimplementować najlepsze rozwiązania dla konkretnego badania jedno- lub wieloośrodkowego, dostosowane do Państwa potrzeb i sugestii Państwa uznanych partnerów do współpracy.
badania kliniczne produktów leczniczych
badania kliniczne wyrobów medycznych
badania kliniczne (dermo)kosmetyków
badania biorównoważności
badania naukowe (inicjowane przez lekarzy)
Nasz wysoce wykwalifikowany zespół posiada doświadczenie w rozwoju eCRF-ów w następujących obszarach terapeutycznych: onkologia, kardiologia, alergologia, dermatologia, gastroenterologia, psychiatria, okulistyka, neurologia, itp.
Cały czas jesteśmy gotowi na nowe wyzwania.
Zastosowania
- Badania jedno- i wieloośrodkowe
- Nieinterwencyjne badania zbierające dane naukowe i udzielające odpowiedzi na postawione pytania badawcze
- Działania zgodne z zasadami Evidence Based Medicine (EBM)
- Zbiór cennych danych epidemiologicznych pożądanych z naukowego punktu widzenia
- Gwarancja przetwarzania danych zgodnie z wymogami polskiego prawa
- Wzrost efektywności pracy lekarza
- Faza I-IV
- Projekt i wdrożenie badania
- Randomizacja, data management, monitoring i analiza danych
- Badania statystyczno-epidemiologiczne
- Działania zgodne ze standardowymi procedurami postępowania (SOP) oraz wymogami Dobrej Praktyki Klinicznej (GCP)
- Tworzenie wizji nowego produktu/reklamy/opakowania i konceptu komunikacyjnego
- Repozycjonowanie produktów już istniejących
- Dostarczenie wiedzy i insightów do zwiększenia rozpoznawalności marki/produktu
- Proste i przydatne narzędzie w rękach lekarza weryfikujące compliance
- Pomoc dla pacjentów z chorobami przewlekłymi w codziennym monitorowaniu różnych parametrów
- Rejestracja przyjmowanych leków i zapis towarzyszących objawów chorobowych lub innych elementów stylu życia
- Stały monitoring zdrowia pacjenta
Zalety elektronicznego systemu gromadzenia danych (ang. electronic data capture system - EDC)

- Dostępność danych 24/7
- Szybszy i bardziej wydajny niż papierowy CRF
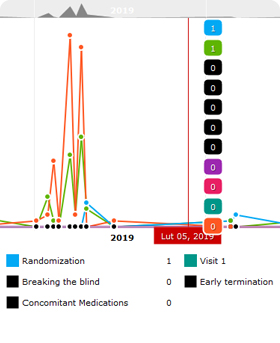
- Moduł śledzenia zmian (ang. audit trail) - pełna historia działań użytkowników w systemie eCRF
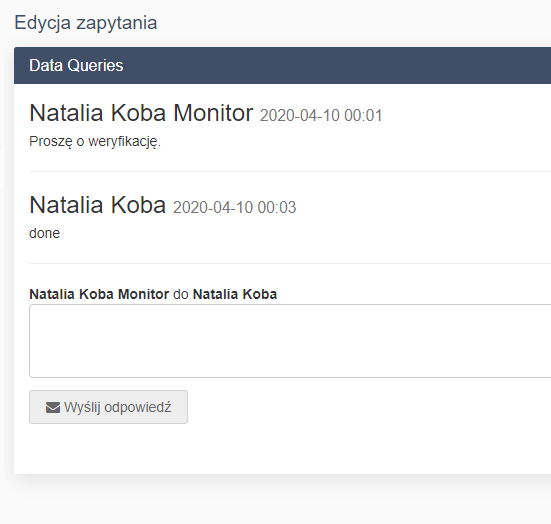
- Zarządzanie zapytaniami do wpisów - moduł data queries
- Moduł komentarzy - przydatne narzędzie w fazie rozwoju eCRF - każda osoba zaangażowana w proces może udzielać wskazówek bezpośrednio w systemie eCRF
- Moduł randomizacji i zarządzania lekami
- Powiadomienia / notyfikacje / automatyczne powiadomienia (np. o zdarzeniach niepożądanych, powiadomienia o statusie pacjenta, otwieranie i zamykanie kohort, powiadomienia e-mailowe itp.)
- Konfigurowalność systemu eCRF
- Podpisywanie umów online
- Dostęp dla wszystkich zainteresowanych (np. Sponsor, Monitor, Monitor medyczny, Programista eCRF, Data Manager, Dostawca leków, Badacz itp.)
- Dynamiczne raporty (np. ogólny postęp badania, status rekrutacji, raport zapytan, wykaz zdarzeń niepożądanych, raport weryfikacji stron / pytań itp.)
- Generowanie wydruków bezpośrednio z systemu eCRF
- Szybki transfer danych ze źródeł zewnętrznych, integracja z laboratoriami
- Wysoki poziom bezpieczeństwa i backup danych
- Monitorowanie płatności
- Pełna cyfryzacja
Zakres usług BioStat®
- Przygotowanie dokumentacji walidacyjnej - Plan walidacji danych (ang. Data Validation Plan), certyfikat walidacyjny (ang. Validation Certificate), raport walidacji danych (ang. Data Validation Report), Specyfikacja walidacji danych (ang. Data Validation Specification), etc.
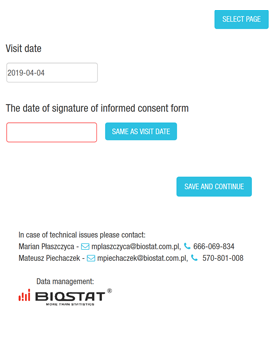
- Elektroniczne formularze - karty obserwacji pacjentów (eCRF) i instrukcje dotyczące wypełniania eCRF dla Badaczy, Monitorów, itp.
- Przygotowanie systemu randomizacyjnego (IWRS, IVRS), zarządzanie lekami, listy randomizacyjne
- Testy akceptacji (User Acceptance Testing (UAT)) - testowanie wszystkich komponentów systemu
- Elektroniczny dziennik obserwacji pacjenta (ePRO)
- Integracja z centralnym i/lub lokalnym laboratorium oraz transfer danych z urządzeń zewnętrznych
- Zarządzanie danymi
- Nadzór nad zgłaszaniem zdarzeń niepożądanych
- Przygotowanie dobrze zaprojektowanej i przejrzystej strony dla badania (dedykowana szata graficzna)
- szkolenia z zakresu obsługi eCRF dla Badaczy
- Kodowanie medyczne (MedDRA)
- Analiza statystyczna i końcowy raport statystyczny
- Helpdesk telefoniczny i e-mailowy
Etapy procesu badawczego.
- Projektowanie badania - konsultacja narzędzia i plan analizy statystycznej
- Przygotowanie elektronicznego formularza - wersja testowa i produkcyjna
- Randomizacja
- Podpisanie umów z uczestnikami badania
- Szkolenie badaczy
- Monitoring i data management
- Interim analyses
- Zamknięcie bazy danych i przygotowanie bazy danych do procesu analizy
- Analiza danych zgodnie z planem analizy statystycznej (SAP)
- Rozliczenia finansowe z badaczami
- Przygotowanie raportu końcowego
Kompleksowy serwis w zakresie zarządzania danymi w badaniach klinicznych i obserwacyjnych.
- Rozwój elektronicznego kwestionariusza obserwacji (eCRF)
- Projektowanie i rozwój struktury baz danych zgodnie ze standardem CDASH
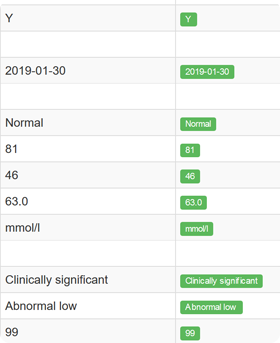
- Bieżąca kontrola jakości danych, zapewniająca spójność i zgodność z wymogami formalnymi
- Zarządzanie kontami użytkowników
- Programowanie walidatorów (ang. edit checks) i testowanie
- Przygotowanie dokumentacji - Plan zarządzania danymi (ang. Data Management Plan), Plan przeglądu jakości danych (ang. Data Quality Review Plan), Przypadki testowe (ang. Test Cases), Plan transferu danych (ang. Data Transfer Plan), itp.
- Identyfikacja brakujących danych lub niepoprawnych wartości
- Zarządzanie zapytaniami
- Współpraca z międzynarodowymi zespołami, bieżąca komunikacja ze sponsorami, monitorami, badaczami
- Czyszczenie bazy danych
- Zamknięcie bazy danych
- Szkolenia i doradztwo
Wybierz najlepszy elektroniczny system gromadzenia danych (EDC).
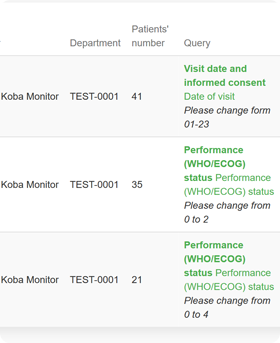
Funkcje systemu eCRF.
Rekomendacje:
Warszawski Uniwersytet Medyczny


W czasie trwania współpracy, firma wykonywała swoje obowiązki profesjonalnie i rzetelnie. Pracownicy firmy są odbierani przez nas jako solidni fachowcy, którzy są w pełni zaangażowani w wykonywaną pracę. W trakcie naszej współpracy wykazali się zrozumieniem i cierpliwością na wprowadzane w projekcie zmiany.
Novartis Poland LLC


The cooperation with BioStat was smooth. The company always prepares all elements of the agreements on time, with no delays. The contacts with BioStat were always very professional and the quality of their work was very high.
Śląski Uniwersytet Medyczny


Projekt i wdrożenie systemu bazodanowego zostało powierzone (...) firmie BioStat. Dzięki profesjonalnemu podejściu firmy BioStat, która zapewniła wsparcie na każdym etapie uruchomienia systemu, mogliśmy w krótkim czasie po rozpoczęciu projektu korzystać z dostarczonego nam rozwiązania skrojonego w pełni na naszą miarę.
Klinika i Zakład Rehabilitacji Kardiologicznej i Elektrokardiologii Nieinwazyjnej

Szybka, profesjonalna i terminowa pomoc w analizie statystycznej materiału do pracy statutowej, realizowanej w Instytucie Kardiologii w Warszawie. Nie bez znaczenia było również przejrzyste i zrozumiałe dla każdego opracowanie wyników. Z pełnym przekonaniem mogę polecić firmę.
Centrum Zdrowia Dziecka


„Bardzo wysoko oceniam wiedzę, podstawy merytoryczne, a przede wszystkim dyspozycyjność zespołu BioStat. Zawsze można było liczyć na wytłumaczenie niezrozumiałej wiedzy statystycznej, proste przełożenie wyników testów statystycznych na wiedzę praktyczną i niezbędną do zastosowania w praktyce klinicznej. Doceniona została duża pomoc graficzna.”
Mabion


Od ponad 2 lat współpracujemy z firmą BioStat w zakresie realizowania badań klinicznych. Stworzyła na potrzeby naszego badania elektroniczny CRF – zajmujący się utrzymaniem i administracją systemu. Firma wywiązuje się ze swoich zadań rzetelnie i terminowo.
Instytut Hematologii i Transfuzjologii


„Wyniki badania przeprowadzonego przez firmę BioStat są obiecujące, a badań takich na temat zastosowania klinicznego jest niewiele. Uzyskane wyniki zostały przedstawione na kilku zjazdach polskich i zagranicznych dotyczących hematologii i transplantacji komórek krwiotwórczych. Nasza współpraca układa się znakomicie. Jesteśmy w stałym kontakcie i mamy nadzieję na dalsze owocne i w pełni profesjonalne współdziałanie.”
Centrum Onkologii


Wykonawca wykonał usługę, jaką było wykonanie badań ilościowych opinii społecznej stanu świadomości zdrowotnej i zachowań zdrowotnych grup docelowych. Projekt 45+ w zakresie chorób układu moczowo-płciowego. Usługę wykonano bez zastrzeżeń i zgodnie z zawartą umową.
Instytut Psychiatrii i Neurologii w Warszawie


Wykonana analiza statystyczna dotycząca wielokrotnego opiniowania sądowo-psychiatryczno-psychologicznego została przeprowadzona zgodnie z umową i bez zastrzeżeń.
Katedra i Klinika Ortopedii Traumatologii Akademii Medycznej w Lublinie


„Zespół BioStat wykazał się biegłą znajomością problematyki medycznej. Współuczestniczył w projektowaniu metodyki badań statystycznych, prowadził obliczenia oraz weryfikował obliczenia innych badaczy.”
Państwowy Instytut Weterynaryjny


Wykonawca konsultował elementy swojej bazy elektronicznej na potrzeby serwera zamawiającego, co umożliwiło nam kontynuację badania w kolejnych latach. Obsługa elektronicznego programu monitoringowego została wykonana sumiennie i profesjonalnie.
Instytut Medycyny Pracy


Firma BioStat wykonywała na zlecenie Zakładu Psychologii Pracy Instytutu Medycyny Pracy w Łodzi aplikację do prowadzenia badań Skalą Ryzyka Psychospołecznego w wersji on-line. Z dużą przyjemnością moge polecić firmę BioStat jako rzetelnego i wiarygodnego partnera biznesowego posiadającego potencjał intelektualny i techniczny pozwalający realizowaćć wymagające i nowatorskie przedsięwzięcia.
Katedra i Klinika Urologii i Onkologii Urologicznej


„Firma BioStat była pomocna w opracowaniu danych statystycznych rzadko omawianego w piśmiennictwie nadużywania substancji anabolicznych. Opracowanie to umożliwiło publikację kilku prac w wiodących czasopismach medycznych i przedstawienie problemu na Kongresie Naukowym Polskiego Towarzystwa Urologicznego.”
Uniwersytet Medyczny im. Piastów Śląskich we Wrocławiu


„Jestem wysoce zadowolony z profesjonalnego i terminowego przeprowadzenia analizy danych statystycznych, niezbędnych podczas pisania pracy doktorskiej. Na uznanie zasługuje wysoki poziom merytoryczny, jak również elastyczność i dopasowanie się do indywidualnych potrzeb klienta.”
Mundipharma Polska Sp z o.o.


„Firma BioStat wywiązała się ze swoich zobowiązań profesjonalnie i terminowo. Zaproponowane rozwiązania techniczne i logistyczne spełniają nasze oczekiwania merytoryczne oraz są intuicyjne dla użytkownika systemu. Wątpliwości oraz pytania są rozwiązywane na bieżąco, bez zbędnego oczekiwania.”
Milton Essex


„Jakość rozwiązań informatycznych dostarczonych przez BioStat przewyższa pod względem funkcjonalności i bezpieczeństwa większość alternatywnych systemów eCRF. Wyrażam uznanie za terminową i profesjonalną realizację wszystkich zdań. Polecamy skorzystanie z usług firmy BioStat Sp z o.o. wszystkim podmiotom działającym w sektorze R&D.”
Najczęściej zadawane pytania.
Tak, system eCRF.biz™ może być zintegrowany z laboratoriami. Jest to proces złożony i czasochłonny, poprzedzony weryfikacją specyfikacji, konsultacjami działów IT Biostat i IT Laboratorium, licznymi testami. Po wykonanej integracji transfer danych laboratoryjnych obywa się w sposób automatyczny.
Zbudowaliśmy wewnątrz organizacji własne centrum zarządzania danymi, które obsługuje wszystkie projekty badawcze realizowane na bazie oprogramowania Biostat eCRF.biz™, ale także eCRFy zewnętrznych firm. W zakres usługi zarządzania danymi wchodzi m.in.: przygotowanie bazy danych, rekoncyliacje, walidacje eCRFów, zarządzanie bazą danych, kontami użytkowników, querami, bieżąca weryfikacja danych, przygotowanie dokumentacji.
Posiadamy licencję na korzystanie ze słownika MEDdra. Aktualnie obowiązującą wersją jest wersja 24.0. Jak tylko pojawiają się aktualizacje jesteśmy o nich informowani i niezwłocznie je implementujemy.
Nie. Z uwagi na fakt, że Biostat® jest autorem i właścicielem oprogramowania nie jest konieczny zakup odrębnej/zewnętrznej licencji. System eCRF sprzedajemy zazwyczaj w modelu usługa realizacji badania w oparciu o nasz system. Jeśli Klient jest zainteresowany zakupem licencji na nasz system, wówczas indywidulanie podchodzimy do tematu wyceny i sprzedaży usługi eCRF w takim modelu biznesowym.
System eCRF jest zgody z FDA 21 eCFR part 11. Gwarantuje dostępność danych 24/7, jest szybszy i bardziej wydajny niż papierowy CRF. Mnogość modułów (audit trail, data queries, komentarze, raporty, statystyki, powiadomienia, alerty, notyfikacje, płatności, itd.) oraz skalowalność i konfigurowalność systemu zapewnia płynną realizację. Możliwa jest integracja z systemem randomizacyjnym, laboratoriami, systemem zawierania umów online a także szybki transfer danych ze źródeł zewnętrznych. Zapewnia wysoki poziom bezpieczeństwa i backupy danych. Pozwala prowadzić nieograniczoną ilość badań. eCRF w każdym badaniu klinicznym jest testowany i walidowany.
Czas oczekiwania na zbudowanie systemu eCRF.biz™ skonfigurowanego pod konkretne badanie kliniczne zawsze dostosowujemy pod oczekiwania klienta, jednakże średni czas to ok. 1,5-2 miesiące.
Czas oczekiwania na utworzenie skonfigurowanego pod konkretne badanie obserwacyjne systemu eCRF.biz™ zawsze dostosowujemy pod oczekiwania klienta, jednakże średni czas od 21 dni do 1 miesiąca.
System eCRF.bizTM został rozwinięty o funkcjonalność raportowania opartą na open source'owym pakiecie statystycznym R. Integracja tego oprogramowania z eCRF.bizTM pozwala na wzbogacenie badań prowadzonych o automatycznie generowane raporty o dowolnym stopniu skomplikowania. Raport może przyjąć formę pliku PDF bądź strony internetowej i zawiera tabele, wykresy oraz aktualizacje o postępach badania.
 Badania kliniczne
Badania kliniczne

