eCRF
Klinische Studiensoftware
-
 Klinische Untersuchungen
Klinische Untersuchungen
-
 Medizinische Register
Medizinische Register
-
 Wissenschaftliche Studien
Wissenschaftliche Studien
-
 Beobachtungsstudien
Beobachtungsstudien
Wir unterstützen bei der Erstellung durchdachter und "intelligenter" eCRFs (elektronischer Patientenbeobachtungsbögen).
Wir übertragen klinische und beobachtende Studien in die digitale Welt.
Wir bieten Ihnen ein einzigartiges, auf dem polnischen Markt erhältliches, mehrmodulares System namens eCRF.biz.plTM an, das speziell für die wissenschaftlichen Anforderungen der pharmazeutischen Branche entwickelt wurde. Bei der Gestaltung haben wir uns an den Richtlinien der FDA (Food and Drug Administration) orientiert, was sich in der Konformität mit Title 21 CFR Part 11 widerspiegelt.
Die benutzerfreundliche Technologie des elektronischen Datenerfassungssystems (EDC),
inspiriert von Forschern und von Profis für Fachleute vorbereitet.
Das System eCRF.bizTM (Clinical Data Management System) ermöglicht Ihnen das einfache und sichere Sammeln von Daten, und die benutzerfreundliche Oberfläche wird von vielen Forschern geschätzt. eCRF.biz.TM ist eine integrierte Forschungsplattform, die papierbasierte klinische Beobachtungsfragebögen vollständig eliminiert und uns ermöglicht, das gesamte Forschungsprojekt umfassend zu verwalten. Das elektronische CRF (elektronischer Fallberichtsbogen) ermöglicht eine viel schnellere Datengewinnung und somit eine sofortige Datenanalyse in jeder Phase der Studie.
Unser System eCRF.bizTM wird von einer breiten Palette von Fachleuten und wissenschaftlichen Einrichtungen genutzt, deren Feedback wertvolle Hinweise im Entwicklungs- und Verbesserungsprozess des Systems sind. In Absprache mit Ihnen können wir die besten Lösungen für eine einzelne oder mehrere Zentren umfassende Studie entwerfen und implementieren, die auf Ihre Bedürfnisse und die Vorschläge Ihrer anerkannten Kooperationspartner zugeschnitten sind.
Nutzen Sie unser eCRF.bizTM - System für kommerzielle und nichtkommerzielle Studien:
Klinische Studien von Arzneimitteln
Klinische Studien von Medizinprodukten
Klinische Studien (Dermo)kosmetika
Bioäquivalenzstudien
Wissenschaftliche Studien (von Ärzten initiiert)
Unser hochqualifiziertes Team hat Erfahrung in der Entwicklung von eCRFs in den folgenden therapeutischen Bereichen: Onkologie, Kardiologie, Allergologie, Dermatologie, Gastroenterologie, Psychiatrie, Augenheilkunde, Neurologie usw.
Wir sind jederzeit bereit für neue Herausforderungen.
Anwendungen
- Sammlung wertvoller epidemiologischer Daten aus wissenschaftlicher Sicht
- Gewährleistung der Datenverarbeitung gemäß den Anforderungen des polnischen Rechts
- Steigerung der Effizienz der Arbeit von Ärzten
- Einzel- und Mehrzentrenstudien
- Nicht interventionelle Studien zur Datensammlung und Beantwortung von Forschungsfragen
- Handeln gemäß den Prinzipien der evidenzbasierten Medizin (EBM)
- Phase I-IV
- Studienentwurf und -umsetzung
- Randomisierung, Datenmanagement, Überwachung und Datenanalyse
- Statistisch-epidemiologische Studien
- Handeln gemäß den Standard Operating Procedures (SOP) und den Anforderungen der Good Clinical Practice (GCP)
- Ein einfaches und nützliches Werkzeug in den Händen des Arztes zur Überprüfung der Therapietreue
- Unterstützung von Patienten mit chronischen Krankheiten bei der täglichen Überwachung verschiedener Parameter
- Aufzeichnung eingenommener Medikamente und begleitender Krankheitssymptome oder anderer Lebensstilfaktoren
- Permanente Überwachung der Patientengesundheit
- Entwicklung einer Vision für neue Produkte/Werbung/Verpackungen und kommunikatives Konzept
- Repositionierung bereits existierender Produkte
- Bereitstellung von Wissen und Einblicken zur Steigerung der Marken-/Produkterkennung
Vorteile des elektronischen Daten-Erfassungssystems (EDC):

- Datenverfügbarkeit rund um die Uhr
- Schneller und effizienter als das papierbasierte CRF
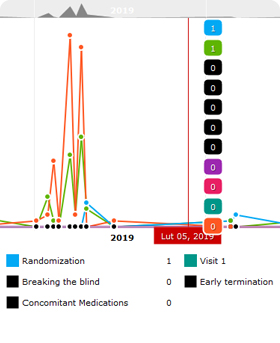
- Änderungsverfolgungsmodul (Audit Trail) - vollständige Historie der Benutzeraktivitäten im eCRF-System
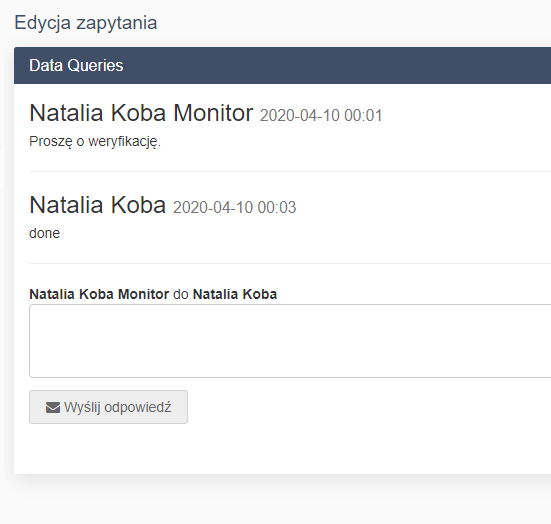
- Verwaltung von Anfragen zu Einträgen - Data Queries-Modul
- Kommentarmodul - nützliches Werkzeug in der eCRF-Entwicklungsphase - jede am Prozess beteiligte Person kann direkt im eCRF-System Hinweise geben
- Randomisierungs- und Medikamentenverwaltungsmodul
- Benachrichtigungen / Meldungen / automatische Benachrichtigungen (z. B. zu unerwünschten Ereignissen, Patientenstatusbenachrichtigungen, Öffnen und Schließen von Kohorten, E-Mail-Benachrichtigungen usw.)
- Konfigurierbarkeit des eCRF-Systems
- Online-Vertragsunterzeichnung
- Zugriff für alle Interessierten (z. B. Sponsor, Monitor, Medizinischer Monitor, eCRF-Programmierer, Datenmanager, Arzneimittellieferant, Forscher usw.)
- Dynamische Berichte (z. B. allgemeiner Studienfortschritt, Rekrutierungsstatus, Anfragebericht, Liste unerwünschter Ereignisse, Seiten- / Frageüberprüfungsbericht usw.)
- Generierung von Drucken direkt aus dem eCRF-System
- Schneller Datenimport aus externen Quellen, Integration mit Laboren
- Hohe Sicherheitsstufe und Daten-Backup
- Überwachung von Zahlungen
- Vollständige Digitalisierung
BioStat®-Servicebereich:
- Vorbereitung der Validationsdokumentation - Datenvalidierungsplan, Validierungszertifikat, Datenvalidierungsbericht, Datenvalidierungsspezifikation, etc.
- Elektronische Formulare - Patientenbeobachtungsbögen (eCRF) und Anweisungen zum Ausfüllen von eCRF für Forscher, Monitore, etc.
- Vorbereitung des Randomisierungssystems (IWRS, IVRS), Medikamentenverwaltung, Randomisierungslisten
- Akzeptanztests (User Acceptance Testing (UAT)) - Testen aller Systemkomponenten
- Elektronisches Patientenbeobachtungsjournal (ePRO)
- Integration mit zentralen und/oder lokalen Laboren sowie Datenübertragung von externen Geräten
- Datenmanagement
- Überwachung der Meldung unerwünschter Ereignisse
- Erstellung einer gut gestalteten und übersichtlichen Studienseite (dediziertes Grafikdesign)
- Schulungen zur Bedienung des eCRF für Forscher
- Medizinisches Kodieren (MedDRA)
- Statistische Analyse und abschließender statistischer Bericht
- Telefonischer und E-Mail-Helpdesk
Phasen des Forschungsprozesses.
Vorbereitung
- Forschungsdesign - Beratung zur Instrumentenwahl und statistischen Analyseplanung
- Erstellung des elektronischen Formulars - Test- und Produktionsversion
- Randomisierung
Durchführung
- Unterzeichnung von Vereinbarungen mit Studienteilnehmern
- Schulung der Forscher
- Überwachung und Datenmanagement
- Zwischenanalysen
Abschluss
- Schließung der Datenbank und Vorbereitung der Datenbank für den Analyseprozess
- Datenanalyse gemäß dem statistischen Analyseplan (SAP)
- Finanzielle Abrechnung mit den Forschern
- Erstellung des Endberichts
Umfassender Service im Bereich Datenmanagement für klinische und Beobachtungsstudien.
- Entwicklung eines elektronischen Beobachtungsfragebogens (eCRF)
- Entwurf und Entwicklung einer Datenbankstruktur in Übereinstimmung mit dem CDASH-Standard
- Laufende Kontrolle der Datenqualität, um die Konsistenz und die Einhaltung der formalen Anforderungen zu gewährleisten
- Verwaltung von Benutzerkonten
- Programmierung von Bearbeitungsprüfungen und Tests
- Erstellung der Dokumentation - Datenmanagementplan, Plan zur Überprüfung der Datenqualität, Testfälle, Datentransferplan usw.
- Identifizierung von fehlenden Daten oder falschen Werten
- Verwaltung von Abfragen
- Zusammenarbeit mit internationalen Teams, laufende Kommunikation mit Sponsoren, Monitoren, Forschern
- Bereinigung der Datenbank
- Schließung der Datenbank
- Schulung und Beratung
Erfolg jeder Studie hängt von der Exzellenz des erstellten eCRF und gut erbrachten Datenmanagement-Dienstleistungen ab. Wählen Sie das beste elektronische Datenerfassungssystem (EDC) aus.
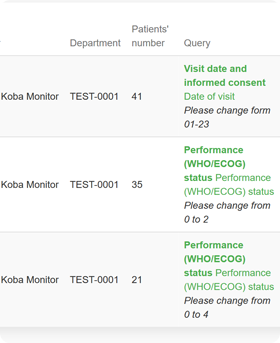
Empfehlungen:
Warschauer Medizinische Universität


Während unserer Zusammenarbeit erfüllte das Unternehmen seine Aufgaben professionell und gewissenhaft. Die Mitarbeiter des Unternehmens werden von uns als zuverlässige Fachleute wahrgenommen, die sich vollständig für ihre Arbeit engagieren. Während unserer Zusammenarbeit zeigten sie Verständnis und Geduld bei der Anpassung an Projektsänderungen.
Novartis Polen GmbH


Unsere Zusammenarbeit mit BioStat verlief reibungslos. Das Unternehmen erstellte stets alle Bestandteile der Vereinbarungen rechtzeitig und ohne Verzögerungen. Unsere Interaktionen mit BioStat waren immer sehr professionell, und die Qualität ihrer Arbeit war außerordentlich hoch.
Schlesische Medizinische Universität


Das Projekt und die Implementierung eines Datenbanksystems wurden der Firma BioStat anvertraut. Dank des professionellen Ansatzes von BioStat, der uns bei jeder Phase der Systemimplementierung unterstützte, konnten wir kurz nach Projektbeginn eine maßgeschneiderte Lösung nutzen.
Klinik und Abteilung für Kardiologische Rehabilitation und Nicht-Invasive Elektrokardiologie

Schnelle, professionelle und termingerechte Unterstützung bei der statistischen Analyse von Materialien für statutarische Arbeiten, die am Institut für Kardiologie in Warschau durchgeführt werden. Auch die klare und verständliche Darstellung der Ergebnisse war von großer Bedeutung. Ich kann das Unternehmen uneingeschränkt empfehlen.
Kinder-Gesundheitszentrum


„Ich schätze das Wissen, die fachliche Grundlage und vor allem die Verfügbarkeit des BioStat-Teams sehr. Sie waren immer bereit, komplexe statistische Kenntnisse zu erklären, die Ergebnisse statistischer Tests in praktisches Wissen umzusetzen, das für die klinische Praxis erforderlich ist. Die umfangreiche grafische Unterstützung wurde ebenfalls geschätzt.“
Mabion


Seit über 2 Jahren arbeiten wir mit der Firma BioStat an klinischen Studien zusammen. Sie haben ein elektronisches CRF für unsere Studie erstellt, das sich mit der Wartung und Verwaltung des Systems befasst. Das Unternehmen erfüllt seine Aufgaben gewissenhaft und pünktlich.
Institut für Hämatologie und Transfusionsmedizin


„Die Ergebnisse der von BioStat durchgeführten Studie sind vielversprechend, und es gibt nur wenige Studien zu klinischen Anwendungen in diesem Bereich. Die erhaltenen Ergebnisse wurden auf mehreren polnischen und internationalen Hämatologie- und hämatopoetischen Zelltransplantationskonferenzen vorgestellt. Unsere Zusammenarbeit verläuft außerordentlich gut. Wir stehen in ständigem Kontakt und hoffen auf weitere fruchtbare und vollständig professionelle Zusammenarbeit.“
Krebszentrum


Der Auftragnehmer hat den Service durchgeführt, der die quantitative Erforschung des sozialen Bewusstseins für Gesundheit und Gesundheitsverhalten von Zielgruppen betrifft. Das Projekt zu 45+ im Bereich der urogenitalen Erkrankungen wurde ohne Beanstandungen und gemäß dem Vertrag durchgeführt.
Institut für Psychiatrie und Neurologie in Warschau


Die statistische Analyse wiederholter gerichtspsychiatrischer und psychologischer Bewertungen wurde gemäß der Vereinbarung und ohne Beanstandungen durchgeführt.
Abteilung und Klinik für Orthopädie und Traumatologie der Medizinischen Universität Lublin


„Das BioStat-Team zeigte ein fundiertes Verständnis für medizinische Fragen. Sie haben an der Entwicklung der Methodik für statistische Forschung mitgewirkt, Berechnungen durchgeführt und die Berechnungen anderer Forscher überprüft.“
Staatliches Veterinärinstitut


Der Auftragnehmer konsultierte Elemente seiner elektronischen Datenbank für die Bedürfnisse des Auftraggebers, was uns ermöglichte, die Studie in den folgenden Jahren fortzusetzen. Das elektronische Überwachungsprogramm wurde gewissenhaft und professionell durchgeführt.
Institut für Arbeitsmedizin in Łódź


Die Firma BioStat führte im Auftrag der Abteilung für Arbeitspsychologie des Instituts für Arbeitsmedizin in Łódź eine Anwendung zur Durchführung von Forschungen zur Psychosozialen Risikoskala online durch. Ich kann BioStat als zuverlässigen und glaubwürdigen Geschäftspartner mit intellektuellem und technischem Potenzial für anspruchsvolle und innovative Projekte wärmstens empfehlen.
Abteilung und Klinik für Urologie und Urologische Onkologie


„BioStat war hilfreich bei der Entwicklung statistischer Daten zu dem selten diskutierten Thema des Missbrauchs von anabolen Substanzen in der Literatur. Diese Entwicklung ermöglichte die Veröffentlichung mehrerer Artikel in führenden medizinischen Zeitschriften und die Behandlung des Themas auf dem Wissenschaftlichen Kongress der Polnischen Gesellschaft für Urologie.“
Schlesische Medizinische Universität in Breslau


„Ich bin äußerst zufrieden mit der professionellen und termingerechten Analyse statistischer Daten, die für meine Doktorarbeit erforderlich sind. Das hohe Niveau an Fachkenntnissen sowie die Flexibilität und Anpassungsfähigkeit an die individuellen Bedürfnisse des Kunden verdienen Anerkennung.“
Mundipharma Polen GmbH


„Die Firma BioStat erfüllte ihre Verpflichtungen professionell und pünktlich. Die vorgeschlagenen technischen und logistischen Lösungen entsprechen unseren fachlichen Erwartungen und sind benutzerfreundlich. Zweifel und Fragen werden umgehend und ohne unnötige Verzögerungen geklärt.“
Milton Essex


"Die Qualität der von BioStat gelieferten IT-Lösungen übertrifft in Bezug auf Funktionalität und Sicherheit die meisten alternativen eCRF-Systeme. Ich schätze die termingerechte und professionelle Umsetzung aller Aufgaben. Wir empfehlen die Nutzung der Dienstleistungen von BioStat Sp z o.o. allen Akteuren im Bereich Forschung und Entwicklung."
Häufig gestellte Fragen.
Ja, das eCRF.biz™-System kann mit Laboren integriert werden. Dies ist ein komplexer und zeitaufwändiger Prozess, der durch die Überprüfung der Spezifikationen, Konsultationen der IT-Abteilungen Biostat und IT-Labor, sowie zahlreiche Tests vorbereitet wird. Nach der Integration erfolgt der Transfer von Labordaten automatisch.
Wir haben ein eigenes Datenmanagementzentrum innerhalb der Organisation aufgebaut, das alle Forschungsprojekte, die auf der Biostat eCRF.biz™-Software basieren, sowie externe eCRFs unterstützt. Die Datenmanagement-Dienstleistungen umfassen unter anderem die Vorbereitung der Datenbank, Reconciliation, eCRF-Validierung, Datenbankmanagement, Benutzerkontenverwaltung, Datenüberprüfung, und die Erstellung von Dokumentation.
Wir besitzen eine Lizenz für die Verwendung des MEDdra-Wörterbuchs. Die aktuelle Version ist derzeit Version 24.0. Sobald Updates verfügbar sind, werden wir darüber informiert und implementieren sie sofort.
Nein. Da Biostat® der Autor und Eigentümer der Software ist, ist der Kauf einer separaten/externen Lizenz nicht erforderlich. Das eCRF-System wird in der Regel im Modell der Studiendurchführung basierend auf unserem System verkauft. Wenn der Kunde jedoch daran interessiert ist, eine Lizenz für unser System zu erwerben, gehen wir individuell auf die Bewertung und den Verkauf des eCRF-Dienstes in diesem Geschäftsmodell ein.
Das eCRF-System entspricht den FDA 21 eCFR Part 11. Es garantiert den 24/7-Zugriff auf Daten, ist schneller und effizienter als ein papierbasiertes CRF. Die Vielzahl von Modulen (Audit Trail, Datenabfragen, Kommentare, Berichte, Statistiken, Benachrichtigungen, Alarme, Mitteilungen, Zahlungen, usw.) sowie die Skalierbarkeit und Konfigurierbarkeit des Systems gewährleisten reibungslose Durchführung. Die Integration mit dem Randomisierungssystem, Laboren, dem Online-Vertragssystem sowie der schnelle Datentransfer von externen Quellen sind möglich. Es bietet ein hohes Maß an Datensicherheit und Datenbackups. Es ermöglicht die Durchführung einer unbegrenzten Anzahl von Studien. Das eCRF wird in jeder klinischen Studie getestet und validiert.
Die Wartezeit für die Konfiguration des eCRF.biz™-Systems für eine bestimmte klinische Studie wird immer an die Erwartungen des Kunden angepasst, aber die durchschnittliche Zeit beträgt ca. 1,5-2 Monate.
Die Wartezeit für die Konfiguration des eCRF.biz™-Systems für eine bestimmte beobachtende Studie wird immer an die Erwartungen des Kunden angepasst, aber die durchschnittliche Zeit beträgt zwischen 21 Tagen und einem Monat.
Das eCRF.bizTM-System wurde um die Reporting-Funktionalität erweitert, die auf dem Open-Source-Statistikpaket R basiert. Die Integration dieser Software mit eCRF.bizTM ermöglicht die Bereicherung von Studien um automatisch generierte Berichte jeder Komplexitätsstufe. Der Bericht kann in Form einer PDF-Datei oder einer Website vorliegen und Tabellen, Diagramme sowie Updates zum Studienfortschritt enthalten.
 Klinische Untersuchungen
Klinische Untersuchungen
